美宝胃肠胶囊维持胚胎小白鼠小肠组织植块存活及重新组合成粘膜组织
[摘 要]:目的:通过体外检测美宝胃肠胶囊(GIC)对胚胎小白鼠小肠器官型植块生长的作用以探索GIC修复粘膜损伤的机理。方法:体外培养胚胎小白鼠小肠器官型植块,并将所有植块分为两组:实验组和对照组。结果:实验组的小肠器官型植块能很好地维持存活,并有大量的单个细胞、细胞克隆以及片状粘膜组织块长出,生长的时间长,生长状态好;而对照组的小肠器官型植块均很快归于死亡。二者差异极为显著。结论:GIC能够维持胚胎小白鼠小肠器官型植块的存活,并能促进细胞增殖,某种程度上维持组织的完整性,重新组合成粘膜组织,此结果可能与GIC激活上皮干细胞有关。
[关键词]:GIC;小肠植块;生长
GIC Could Maintain Survival and Promote Cell Growth of Organ-Type Explants of Intestine of Mouse Embryo Xu rong-xiang,Wang Yan-ping,Fan Ran,etc。
Central laboratory, MEBO Global Group 100053
[Abstract]: Objective: To research on the reparative mechanism of GIC on intestinal lesion through examining the effect of on the survival and cell growth of organ-type explants of intestinal tissue of mouse embryo. Methods: Cultured the organ-type explants of mouse intestinal tissue in vitro, all the explants were divided into two groups: test group and control group. Results: Explants could survive in test group. Single cells, cell clones and tissue pieces could grew out of the explants and grew long and well in test group. Conclusion: could maintain survival of intestinal explants and promote growth of cells from intestinal explants of mouse embryo and this process may be involved in the activation of epithelial stem cells.
[Key words]: GIC; intestinal explant ; growth
大量临床实践显示,GIC可能也是通过激活粘膜上皮干细胞、促进组织细胞生长的机理实现对损伤粘膜修复的,为了证明这一观点,我们特设计了本实验。
一. 仪器、设备、材料、试剂及实验动物
![]() 培养箱(美国Forma)、冰箱(江苏长岭)、倒置显微镜(重庆光学仪器厂)、超级恒温水浴及恒温电烤箱(重庆四达)、超净工作台(北京半导体设备二厂)、显微成像分析系统(上海科瑞)、微波炉(广东Galanz)、微型计算机(北京沐泽)、光学显微镜(江苏光学仪器厂)、各种型号注射器、12孔培养板(丹麦NUNC)、50ml离心管、Eppendorf离心管、微量加样器(1000μl、200μl、20μl、10μl, 均为法国Gilson)、大小滴头、玻璃培养皿(φ5cm、φ6cm)、0.22μm微孔滤膜、针头滤器、显微外科器械、各种眼科手术器械、有盖三角烧瓶、有盖小试管、针头、GIC(美宝公司生产)、MEM培养基(美国Hyclone)、胎牛血清(杭州三利)、青霉素和链霉素(华北制药)等。
培养箱(美国Forma)、冰箱(江苏长岭)、倒置显微镜(重庆光学仪器厂)、超级恒温水浴及恒温电烤箱(重庆四达)、超净工作台(北京半导体设备二厂)、显微成像分析系统(上海科瑞)、微波炉(广东Galanz)、微型计算机(北京沐泽)、光学显微镜(江苏光学仪器厂)、各种型号注射器、12孔培养板(丹麦NUNC)、50ml离心管、Eppendorf离心管、微量加样器(1000μl、200μl、20μl、10μl, 均为法国Gilson)、大小滴头、玻璃培养皿(φ5cm、φ6cm)、0.22μm微孔滤膜、针头滤器、显微外科器械、各种眼科手术器械、有盖三角烧瓶、有盖小试管、针头、GIC(美宝公司生产)、MEM培养基(美国Hyclone)、胎牛血清(杭州三利)、青霉素和链霉素(华北制药)等。
实验动物:昆明种胚胎小白鼠
二. 实验方法:
1.取孕16日龄的昆明雌性小白鼠,颈椎脱臼法处死之,先置于75%乙醇中粗洗一遍(2分钟),再置于75%乙醇中消毒5分钟;
2.用眼科剪以及止血钳先剪开雌鼠的腹部皮肤,钝性分离至两侧,充分暴露腹壁肌肉,然后小心剪开腹壁全层,切勿伤及内脏及小鼠胚胎;
3.剪开子宫,从宫腔中取出胚胎鼠,置入无菌平皿中;
4.用双抗-冷PBS将胚胎鼠体表洗涤两次,每次1分钟;
5.用显微外科剪刀将胚胎鼠的腹壁剪开,再用显微外科镊子夹起鼠近胃端小肠(包括十二指肠和空肠),截取2cm左右;
6.用双抗-冷PBS将胚胎鼠小肠连续洗涤两次,每次1分钟;
7.用显微外科剪刀将肠管纵行切开,充分暴露粘膜面;
8.用双抗-冷PBS将胚胎鼠小肠连续洗涤两次,每次1分钟;
9.将鼠小肠置于含双抗(青、链)的MEM培养液中冲洗2次,每次1分钟;
10.将鼠小肠剪成极小的器官型植块,大小约1mm×1mm;
11.将植块置于12孔培养板的培养孔中央,每孔5块,间隔约2mm,布局合理,粘膜面向上,轻轻按压每块植块,使其紧贴培养板的表面;
12.沿着培养孔的边缘,每孔中加入约0.5ml的完全MEM培养液,勿使培养液与植块接触;
13.将培养板置于37![]() ,5%
,5%![]() 培养箱中预孵育1.5小时;
培养箱中预孵育1.5小时;
14.每孔加完全MEM培养液2ml,轻拿轻放,切勿使植块飘起,实验组加GIC;
15.实验组和对照组同步等量换液,每次去掉原液的1/2左右, 再加入相同量的新鲜MEM培养液;
16.用倒置显微镜观察植块生长情况,用显微成像记录分析系统记录所观察的结果,并用计算机保存图像。
三.实验结果
细胞培养110天内的报告结果:实验组和对照组的肠组织植块在培养之初,均能固定在培养孔中央,但随着培养时间的推移,植块逐渐脱离培养孔底部平面,游离飘浮于深层培养液中,悬浮的位置仍然靠近培养孔底部,但仍然集中于培养孔中央,少数位于周边,植块的大小和形状几乎没有变化,但在培养的第10天左右,组织块就开始变得膨松,然后逐渐裂解为很小的组织块,并最终成为肉眼不易察觉的组织块,这时在视野中发现了单个细胞以及细胞克隆。在培养的第20天,对照组中的细胞以及细胞克隆逐渐死亡,而实验组细胞依旧生长良好,单个细胞越来越多,在视野中到处可见,以位于中央部位的最多,细胞圆形,细胞核清晰。细胞呈典型活细胞状态。越向外越少,边缘几乎没有,细胞克隆数也逐渐增多。每个克隆所含有的细胞个数随着时间的推移也越来越多。上述结果说明含15%胎牛血清的MEM培养基无法提供给组织块合适而充足的营养,而GIC作为高级细胞培养基能够提供给细胞合理而充足的营养,保证了组织和细胞的活性。
下面为培养过程中,实验组和对照组的对比图谱,可以深刻反映两组的差别。
|
图1 培养第24天。图1A为对照组,图1B为实验组。对照组中的小肠组织细胞或细胞克隆已经死亡,实验组中显示的是大量单个的小肠组织细胞,但其中没有克隆。
|
|
 |
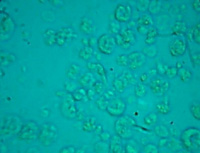 |
| 图2 培养第30天。图2A为对照组,图2B为实验组。对照组中为位于视野中央的大量小肠组织细胞或细胞克隆已经死亡,实验组中显示的是即将形成克隆的细胞。 | |
 |
 |
|
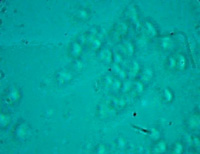
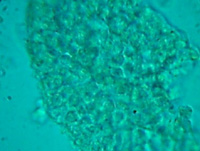
图3 培养第38天。图3A为对照组,图3B为实验组。对照组中的小肠组织细胞或细胞克隆已经死亡,实验组中显示的是一块较为完整的小肠粘膜组织。
|
|
 |
 |
|
图4 培养第42天。图4A为对照组,图4B为实验组。对照组中的小肠组织细胞或细胞克隆已经死亡,实验组中显示的是一块小肠粘膜组织。
|
|
 |
 |
|
图5 培养第50天。图5A为对照组,图5B为实验组。对照组中的小肠组织细胞或细胞克隆已经死亡,实验组中显示的是两块小肠粘膜组织。
|
|
 |
 |
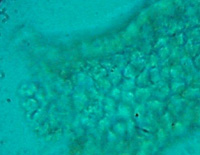
| 图6 培养第85天。图6A为对照组,图6B为实验组。对照组中的小肠组织细胞或细胞克隆已经死亡,实验组中显示的是一块小肠粘膜组织。 | |
 |
 |
|
图7 培养第90天。图7A为对照组,图7B为实验组。对照组中的小肠组织细胞或细胞克隆已经死亡,实验组中显示的是大量的分散生长的小肠组织细胞。
|
|
 |
 |
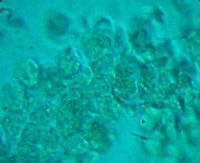
| 图8 培养第97天。图8A为对照组,图8B为实验组。对照组中的小肠组织细胞或细胞克隆已经死亡,实验组中显示的是一块由细胞连接起来的片状结构。 | |
 |
 |
GIC可使离体肠粘膜细胞在培养液中重新连接组合成粘膜组织
现在一般均采用Trowell法进行体外小肠粘膜组织的器官型培养![]() ,此法从人体或动物经口腔取材,取材部位为十二指肠远端和空肠近端,将取出的粘膜(不可能是纯粹的粘膜组织,应该还包括粘膜下层、肌层等等,这与我们的做法一致),将粘膜放在金属网格上,然后粘膜连同网格一起置于多孔培养板中央的孔,其它孔中置入无菌生理盐水浸泡过的无菌纱布以便保持湿度,盖好,置入一个密闭容器中,通95%的氧气和5%的
,此法从人体或动物经口腔取材,取材部位为十二指肠远端和空肠近端,将取出的粘膜(不可能是纯粹的粘膜组织,应该还包括粘膜下层、肌层等等,这与我们的做法一致),将粘膜放在金属网格上,然后粘膜连同网格一起置于多孔培养板中央的孔,其它孔中置入无菌生理盐水浸泡过的无菌纱布以便保持湿度,盖好,置入一个密闭容器中,通95%的氧气和5%的![]() ,37
,37![]() 培养箱中培养。这是目前通用的方法。但此法有明显的缺点,即方法较为繁琐,取材量有限,一般每次不能多于10块活组织,多了容易引起胃肠道出血,取材量受到限制,我们现在采用的方法对其进行了很大的简化,直接从新处死的胚胎动物体内获得无菌小肠粘膜组织,取材过程极容易控制量,也容易控制部位,特别方便快捷。
培养箱中培养。这是目前通用的方法。但此法有明显的缺点,即方法较为繁琐,取材量有限,一般每次不能多于10块活组织,多了容易引起胃肠道出血,取材量受到限制,我们现在采用的方法对其进行了很大的简化,直接从新处死的胚胎动物体内获得无菌小肠粘膜组织,取材过程极容易控制量,也容易控制部位,特别方便快捷。
由于体外培养目前还没有适宜的人工合成培养基,现有的报道体外培养的小肠粘膜组织维持存活时间较短,不管是用RPMI-1640培养基(附加葡萄糖、胰岛素、谷氨酰胺和胎牛血清),还是用Trowell培养基(附加胎牛血清),细胞均最多存活24~48小时,之后就会出现退化和死亡,一般很难超过48小时,培养基中如果不加血清,时间更短,6~12小时会退化坏死,由于植块存活时间短,给实验者提供的检测时间也很短,使多项目检测不可能,只能检测那些用药之后立即就出现的反应,长期效应无法观察,使实验受到了很大限制。而在本实验中我们使用的含有GIC细胞高级培养基直接打破了现有培养基方面的限制,可以长期培养离体肠粘膜组织,可以长期在光镜下直接观察GIC对粘膜生长的影响。
本实验中,GIC对肠粘膜组织的细胞保护作用也得到了明显体现;对于培养过程中观察到的片状粘膜组织,之所以能存在很久时间,并且其内的细胞生长良好,是GIC对细胞外基质的正常代谢产生了影响,细胞外基质是维系细胞相互连接的基础。
为什么胃粘膜能够在这种环境中长期生长呢?有两个原因:一是GIC是营养丰富的细胞培养基及良好的细胞保护剂,另一个是肠道粘膜组织中有粘膜上皮干细胞,GIC启动了干细胞,使干细胞得以较长时间地生长。
对于第一个问题的解释:
GIC有效成分中含有的亚油酸是细胞必需的脂肪酸,是构成细胞生物膜不可缺少的组分,是皮肤、粘膜及深层组织损伤后进行修复的重要材料;有效成分中含有的多种氨基酸如蛋氨酸、半胱氨酸、精氨酸、亮氨酸以及多种脂类物质、维生素、微量元素,为肠粘膜细胞的生长提供了丰富的营养;有效成分还具有抗病原微生物作用,对多种细菌、病毒、真菌、原生物都有较强的抑制作用,同时具有抗炎作用;药物中的有效成分还可以促进细胞的能量代谢,蛋白质及核酸合成和生物膜转运等功能;缓慢释放,使细胞持续得到稳定的营养供应![]() 。
。
GIC的抗氧化作用表现为抗自由基、稳定细胞膜。自由基是广泛存在于各种化学反应中的活泼基团,倘若其产生过量,从而引发所谓的自由基链式反应,则将导致细胞膜多不饱和脂肪酸的脂质过氧化,所产生的大量脂质过氧化物会损伤细胞膜及细胞内的大分子蛋白质与核酸,对细胞造成损伤。有效成分中维生素E的抗自由基功能是由于其自身结构具有还原性,进而捕捉自由基从而阻断自由基链式反应,起到对机体的保护作用,而其自身则经过维生素C和含硫氨基酸的再生而还原或转变为醌类化合物。大量维生素E的存在可使细胞处于流动性高、通透性严密的状态。这除了可保护膜上大量的多不饱和脂肪酸不被氧化外,还与其可以保护膜蛋白的活性结构有关。
对于第二个问题的解释:
肠道粘膜组织中有粘膜上皮干细胞,在合适条件下能够长期生长,GIC有能力启动干细胞使之活化。肠道粘膜的上皮组织来源于上皮干细胞(epithelial stem cell), 用![]() -胸腺嘧啶脱氧核苷(
-胸腺嘧啶脱氧核苷(![]() -TdR)标记放射自显影法观察瞬间标记后的肠腺细胞发现,上皮干细胞位于或靠近肠隐窝的部位
-TdR)标记放射自显影法观察瞬间标记后的肠腺细胞发现,上皮干细胞位于或靠近肠隐窝的部位![]() 。为了维持动态平衡,这些干细胞不断转化为短暂繁殖细胞并向中段移动,最后要么分化为具有吸收功能的刷状缘上皮细胞,要么分化为肠道内分泌细胞。分化后的细胞最后死亡并且从肠绒毛上脱落下来并进入肠腔,任何干细胞都具有生长繁殖的能力,它们是一群分化较低的细胞,这是干细胞与分化细胞明显的不同,体外培养中最容易增殖的正常细胞是干细胞,干细胞属于未分化细胞,尽管脱离了体内生长的微环境,但仍然具有较强的增殖能力。可以断言由于GIC具有激活表皮干细胞的能力,对粘膜干细胞也应该有相应的激活能力。
。为了维持动态平衡,这些干细胞不断转化为短暂繁殖细胞并向中段移动,最后要么分化为具有吸收功能的刷状缘上皮细胞,要么分化为肠道内分泌细胞。分化后的细胞最后死亡并且从肠绒毛上脱落下来并进入肠腔,任何干细胞都具有生长繁殖的能力,它们是一群分化较低的细胞,这是干细胞与分化细胞明显的不同,体外培养中最容易增殖的正常细胞是干细胞,干细胞属于未分化细胞,尽管脱离了体内生长的微环境,但仍然具有较强的增殖能力。可以断言由于GIC具有激活表皮干细胞的能力,对粘膜干细胞也应该有相应的激活能力。
至于生长的细胞的性质,我们认为一定是粘膜细胞,主要原因有两个:一是因为上皮干细胞在体外有较强的增殖功能,这已经为许多研究结果所证实,肠壁其它细胞均不具备这种能力,本实验所用的标本中,除粘膜细胞外,数量最多的应该是肠壁的平滑肌细胞,平滑肌细胞在体外可进行有限的增殖,但不能长期增殖。本实验完全可以排除平滑肌细胞生长的可能性,因为培养自始至终未曾发现形态呈条形或梭形、排列呈束状的平滑肌细胞生长。再次,目前还没有发现平滑肌干细胞,这也是平滑肌在体外不易长期生长的重要原因。其它细胞如粘膜下层疏松结缔组织中的动脉、静脉、淋巴管、神经纤维和粘膜下神经丛等组织的细胞能如此生长的可能性极小。第二个原因是优势生长的问题,当某种细胞特别容易生长的时候,其它细胞的生长就会受到一定程度的抑制或者完全被抑制,本实验中肠粘膜细胞在生长中占优势或绝对优势。
参 考 文 献
1. Trier J S. Organ culture of mucosa of human small intestine. Methods in cell biology, Academic Press Inc, 1980; Volume 21B, 365
2. 邹仲之 陈东 尹昕。消化管。在“组织学”。成令忠 主编。北京:人民卫生出版社,1981:1082
3. 郭燕世, 王玲, 王志均。油酸钠对消炎痛引起小鼠胃粘膜损伤的保护作用。 北京医科大学学报 1987;3(9):161
4. 杨素娟,郭燕世。油酸对消炎痛引起的胃粘膜损伤大鼠胃粘液分泌的影响。 生理学报,1985; 37(6):532
5. 孙庆伟,滕敏昌,侯奕,等。江西医药, 1994;29(1):1
6. Kiprono PC, Kaberia F, Keriko JM,et al. The in vitro anti-fungal and anti-bacterial activities of beta-sitosterol from Senecio lyratus (Asteraceae). Z Naturforsch [C], 2000; 55(5): 485
7. MacDonald H B. Conjugated linoleic acid and disease prevention: a review of current knowledge. Journal of the American College of Nutrition, 2000;19(20):111s